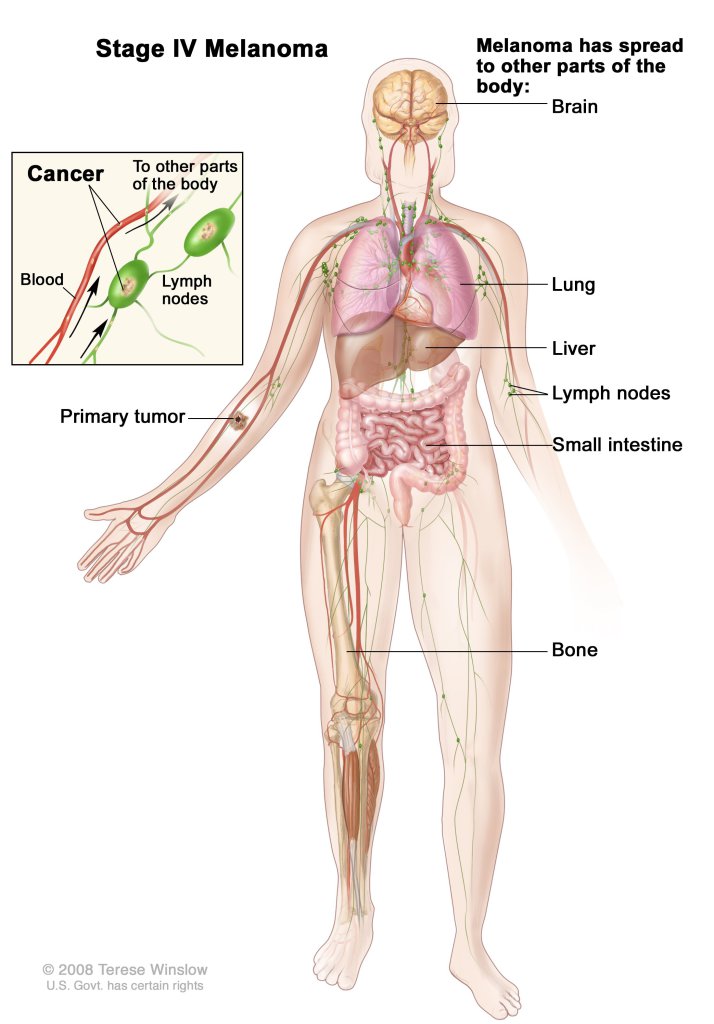
 Die bereits publizierte Phase II Studie NCT00658437 bei Patienten mit metastasierendem Hautkrebs (Melanom) (Trefzer et al. 2014) wurde einer erweiterten Auswertung unterzogen, weil ein Zusammenhang zwischen dem Auftreten von lokalen Hautreaktionen bei den Patienten nach der subkutanen Injektion von ME-503 und dem klinischen Ergebnis für möglich gehalten wurde. Somit bezog sich die erweiterte Auswertung auf die Phase-II-Daten der Patientenkohorten mit / ohne Hautreaktionen innerhalb des ersten Behandlungszyklus nach SC-Injektion.
Die bereits publizierte Phase II Studie NCT00658437 bei Patienten mit metastasierendem Hautkrebs (Melanom) (Trefzer et al. 2014) wurde einer erweiterten Auswertung unterzogen, weil ein Zusammenhang zwischen dem Auftreten von lokalen Hautreaktionen bei den Patienten nach der subkutanen Injektion von ME-503 und dem klinischen Ergebnis für möglich gehalten wurde. Somit bezog sich die erweiterte Auswertung auf die Phase-II-Daten der Patientenkohorten mit / ohne Hautreaktionen innerhalb des ersten Behandlungszyklus nach SC-Injektion.
Es zeigte sich ein hochsignifikanter Unterschied bzgl. der medianen Gesamtüberlebensraten bei Patienten mit Reaktionen an der Injektionsstelle gegenüber Patienten ohne Hautreaktionen.
Vorläufige Schlussfolgerungen aus unseren kleinen Kohorten deuten auf eine starke klinische Wirkung von ME-503 bei Patienten mit zuvor behandeltem metastasiertem Melanom hin, wenn diese Patienten Reaktionen an der Injektionsstelle als unerwünschte Ereignisse nach einer SC-Injektion innerhalb des ersten Behandlungszyklus aufweisen. Patienten ohne Reaktionen an der Injektionsstelle hatten offenbar offenbar keinen klinischen Nutzen von der Therapie.